قانون اول ترمودینامیک به بیان رابطه گرما ، کار و انرژی درونی یک سیستم می پردازد. این قانون یکی از قوانین چهار گانه ترمودینامیک است. و قبل از پرداختن به آن بهتر است قانون صفرم ترمودینامیک را بدانیم. قانون صفرم ترمودینامیک بیان میکند که اگر دو سیستم با سیستم سومی در حال تعادل گرمایی باشند، با یکدیگر در حال تعادلند. همچنین باید راه های تبادل انرژی را بشناسیم.
تبادل انرژى بین محیط و دستگاه از دو طریق گرما و کار صورت میگیرد و معمولاً فرض میشود که دستگاه در حین تبادل گرما، در تماس با یک منبع گرما است.
گرما
گرما انرژی اى است که به سبب اختلاف دما، بین دو جسم مبادله میشود. محیط و دستگاه نیزهنگامی مبادله گرما دارند که با هم اختلاف دما داشته باشند.بنابه قرارداد، گرمایى را که دستگاه میگیرد، با علامت مثبت، و گرمایى را که دستگاه از دست میدهد، با علامت منفى نشان میدهیم.درترمودینامیک دستگاه با یک منبع گرما مبادله گرما میکند که درادامه، آنرا معرفی میکنیم. گرما را به علامت Q نشان می دهیم.
منبع گرما
یک منبع گرما جسمی است که جرم آن در مقابل جرم دستگاهی که با آن تبادل گرما دارد، چنان بزرگ است که میتواند مقدار زیادی گرما بگیرد، یا از دست بدهد، بی آنکه تغییر دمای محسوسی بکند.
هرگاه یک استکان چای داغ یا یک قطعه یخ را در هوای اتاق بگذاریم، پس از مدتی چای خنک شده و یخ ذوب میشود و دمایشان با دمای هوا برابر میشود، بی آنکه دمای هوای اتاق تغییر محسوسی کند. در این مثال، هوای اتاق را برای چای یا قطعه یخ، منبع گرما میگویند.
کار
شکل زیر،گازی را درون یک استوانه نشان میدهد. اگر گاز را کمی گرم کنیم، گاز منبسط میشود و پیستون که اصطکاک ناچیزی دارد به سمت چپ جابه جا میگردد. در این جابه جایی نیروی F که گاز به پیستون وارد میکند، کار انجام میدهد. مقدار این کار برابر با حاصل ضرب بزرگی نیروی F در اندازه جابه جایی پیستون است.
در اینجا ما به محاسبه کار نمی پردازیم و در مطالب دیگری برای هر فرایند ترمودینامیکی می گوییم کار با چه رابطه ای محاسبه می شود.
انرژی درونی
انرژى درونى یک ماده با مجموع انرژی هاى اجزای تشکیل دهنده آن ماده برابر است. به طور دقیق تر، مىتوان گفت که انرژى درونى ماده که آن را با U نشان میدهیم، با مجموع انرژى هاى جنبشى و پتانسیل ذره هاى آن ماده برابر است. هنگامى که دستگاه در حالت معینى قرار دارد، مقدار U مشخص است. این مقدار به کمیت های فشار و دما بستگی دارد.
در مورد گاز کامل (آرمانی) انرژی درونی فقط تابع دمای گاز است. به طوری که با افزایش دما، انرژی درونی گاز افزایش می یابد و با کاهش دما، انرژی درونی گاز کاهش می یابد.
قانون اول ترمودینامیک
هنگامی که دستگاه در یک فرایند ترمودینامیکی ایستاوار با مبادله کار یا گرما و یا هر دو از حالت اول با انرژی درونی U1 به حالت دوم با انرژی درونی U2 می رود، تغییر انرژی درونی از رابطه زیر محاسبه می شود که به مقدار گرما و کار مبادله شده بین دستگاه و محیط بستگی دارد.
قانون اول ترمودینایک به صورت رابطه زیر بیان می شود.
که در آن مقادیر مثبت و منفی به صورت زیر جایگذاری می شود:
اگر گرما از محیط وارد دستگاه شود Q>0 و اگر گرما از دستگاه وارد محیط شود Q<0 خواهد بود .
در صورتی که دستگاه روی محیط کار انجام دهد W<0 و در صورتی که محیط روی دستگاه کار انجام دهد W>0 است .
مثال هایی از قانون اول ترمودینامیک
مثال ۱: در یک فرایند ترمودینامیکی دستگاه ۴۲۰ ژول گرما از محیط می گیرد و انبساط می یابد. اگر کاری که دستگاه روی محیط انجام می دهد ۱۰۰ ژول باشد، تغییر انرژی درونی دستگاه چقدر است؟
پاسخ : چون دستگاه از محیط گرما می گیرد علامت Q مثبت و چون دستگاه روی محیط کار انجام می دهد، علامت w منفی است. بنابراین خواهیم داشت.
مثال ۲: وقتی یک گاز کامل در ظرفی عایق بندی شده، با بالا بردن پیستون، به آرامی افزایش حجم دهد، دمای گاز افزایش می یابد یا کاهش؟
پاسخ: دمای گاز کاهش می یابد. تبادل گرما بین دستگاه و محیط نداریم چون دستگاه عایق بندی شده است پس مقدار گرما صفر است.در نتیجه ΔU=W می شود. و از آن جایی که دستگاه روی محیط کار انجام می دهد، علامت کار و در نتیجه تغییر انرژی درونی منفی می شود.یعنی انرژی درونی گاز در این فرایند کاهش می یابد. چون تغییر انرژی درونی یک گاز کامل فقط به دما بستگی دارد، پس دما نیز کاهش می یابد.
ممکن است در یک فرایند برای گاز کامل تغییر دما نداشته باشیم یعنی T1=T2 . درنتیجه تغییر انرژی درونی نیز صفر می شود.
در اینصورت اندازه کار و گرما یکسان است اما علامت هایشان مخالف یکدیگر می شود.
در برخی از دستگاه ها تغییر حالت ها در طی چند فرایند انجام می شود طوری که دمای گاز در نهایت برابر مقدار اولیه می شود. که به آن یک چرخه می گوییم. تغییرات انرژی درونی برای یک چرخه کامل صفر است.



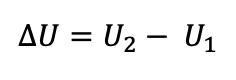
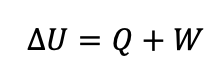
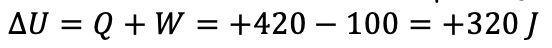
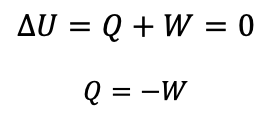

2 دیدگاه دربارهٔ «قانون اول ترمودینامیک»
سلام لطفا حل سوالات فیزیک کنکور ۱۴۰۱ ریاضی خارج را قرار دهید
از بخش ترمودینامیک این کنکور سوال دارم
در سوال ۱۹۰ : نموداری که در سوال اومده فرایند هم دما را نشون میده و در فرایند هم دما هم گرمایی که گاز از محیط می گیرد از رابطه ی Q=-W به دست می آید . W هم مساحت ذوزنقه است که ۷۵۰ می شود و چون علامت گرما مثبت است پس کار منفی مشود و جواب سوال ۷۵۰ ژول می شود ولی پاسخی که در دفترچه اومده ۲۰۰۰ ژول است علت این ۲۰۰۰ ژول را لطفا توضیح دهید
سلام. بزودی حل خواهد شد. نمودار مورد نظر هم دما نیست. در واقع هیچ کدام از نمودارهای خاص نیست. از اونجایی که دما هشت سوم برابر شده پس انرژی درونی نقطه ۲ هم به همین اندازه تغییر می کند. اختلاف انرژی درونی ۱۲۵۰ ژول می شود. پس گرما ۲۰۰۰ ژول است.