ترمودینامیک علمی است که به مطالعه ی رابطه بین کار و گرما و چگونگی تبدیل آنها به یکدیگر می پردازد. در ترمودینامیک از کمیت های P و V و T استفاده می شود که همگی کمیت های ماکروسکوپی ( کمیت هایی که وضعیت ماده را در مقیاس بزرگ توصیف می کنند) هستند . رابطه ی بین این کمیت ها را معادله حالت ترمودینامیکی گویند.
در ترمودینامیک تحولات جسم خاصی را در نظر می گیریم که معمولا به شکل گاز یا مایع است و با محیط پیرامون خود گرما و کار مبادله می کند. این جسم را دستگاه و اجسام پیرامون دستگاه را که می توانند با آن تبادل انرژی داشته باشند، محیط می نامیم.
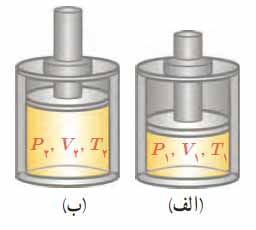
معادله حالت ترمودینامیکی برای گاز کامل (آرمانی)
به هر یک از حالت های الف و ب در شکل بالا که می توان متغیر های ترمودینامیکی را در حالت تعادل دستگاه حساب کرد، حالت تعادل ترمودینامیکی گوییم.
در صورتی که گاز به اندازه کافی رقیق باشد یا چگالی آنها به حد کافی کم باشد، یعنی مولکول های این گاز ها به حدی از هم دور باشند که تاثیر چندانی بر روی یکدیگر نگذارند، گاز را گاز کامل یا گاز آرمانی می نامند.
متغیر های ترمودینامیکی مستقل از یکدیگر نیستند و با هم رابطه دارند. رابطه بین متغیر های ترمودینامیکی را معادله حالت می نامند. اگر گاز کامل باشد، معادله حالت آن ساده و مستقل از نوع گاز است و به صورت زیر داده می شود.
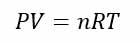
P در این معادله فشار گاز است و یکای آن پاسکال (pa) است. V نشان دهنده حجم گاز است و یکای آن متر مکعب است. T دمای گاز بر حسب کلوین است. n مقدار گاز بر حسب مول و R ثابت عمومی گازها است.
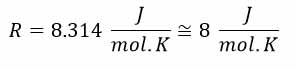
n از رابطه زیر بدست می آید.
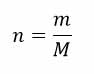
که در آن m جرم گاز بر حسب گرم و M جرم مولکولی بر حسب گرم بر مول است .
قانون آووگادرو
آمدئو آووگادرو دانشمند ایتالیایی در سال ۱۸۱۱ میلادی بیان کرد که در دما و فشار یکسان، نسبت حجم گاز (V) به تعداد مولکول های آن (N) ثابت است.
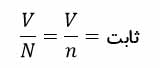
که این رابطه به قانون آووگادرو مشهور است. در یک مول از گاز به تعداد عدد آووگادرو مولکول وجود دارد.
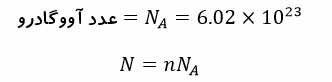
برای n مول گاز کامل رابطه ی زیر همواره مقدار ثابتی دارد.
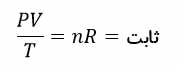
در نتیجه می توان نوشت.
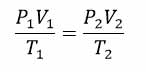
حل مثال های کاربرد قانون گازها
مثال ۱: در آزمایشی، دمای مقدار معینی گاز اکسیژن را در فشار ثابت از ۲۷ درجه سلسیوس به ۸۷ در جه سلسیوس می رسانیم. اگر حجم گاز ابتدا ۲ لیتر باشد، حجم آن را در پایان آزمایش حساب کنید.

مثال ۲: راننده ای پیش از حرکت، فشار لاستیک اتومبیل خود را با یک فشار سنج اندازه می گیرد و برای آن مقدار ۲۱۴ کیلوپاسکال را بدست می آورد. در این زمان، دما برابر با ۱۵ درجه سلسیوس است. پس از چند ساعت رانندگی، توقف می کند و فشار لاستیک را دوباره اندازه می گیرد. اینک فشار ۲۴۱ کیلوپاسکال شده است. اکنون دمای هوای داخل لاستیک چقدر است؟ از تغییر حجم کم هوای درون لاستیک چشم پوشی کنید و فرض کنید فشار هوای محیط برابر با ۱۰۱ کیلوپاسکال باشد.

مثال ۳: درون استوانه ای ۱۲ لیتر گاز اکسیژن با دمای ۷ درجه سلسیوس وجود دارد. فشار گاز درون استوانه را با فشارسنجی اندازه می گیریم. فشار سنج ۱۴ اتمسفر را نشان می دهد. دمای گاز را به ۷۷ درجه سلسیوس و حج آن را به ۱۵ لیتر می رسانیم. فشاری که فشار سنج در پایان نشان می دهد، چند اتمسفر است؟ فشار هوای بیرون استوانه ۱ اتمسفر است. فرض کنید گاز درون استوانه، گاز کامل است.

مثال ۴: مقداری هلیم در حجم ثابت ۲۰ لیتر در اختیار داریم. اگر دمای گاز را ۱۵۰ درجه سلسیوس بالا ببریم، فشار گاز از ۱٫۵ اتمسفر به ۱٫۸ اتمسفر می رسد. مقدار این گاز چند مول است؟ (R=8,1atm=105Pa)
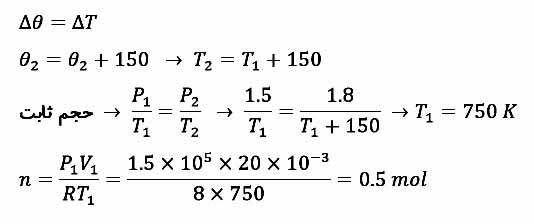
چند فعالیت کاربردی از معادله حالت ترمودینامیکی
۱ – سر سرنگی را که پیستون آن آزادانه حرکت می کند به فشار سنجی بسته و آن را به صورت افقی درون ظرف آب قرار می دهیم و ظرف را به آرامی گرم می کنیم. به دلیل آزادانه حرکت کردن، اصطکاک پیستون سرنگ با سیلندر کم است، پیستون هیچ اختلاف فشاری را برای هوای درون سرنگ با آب بیرون سرنگ تحمل نمی کند و همواره طوری جابه جا می شود و در وضعیتی قرار می گیرد که فشار هوای درون سرنگ با فشار آب بیرون آن برابر باشد. چون در این آزمایش فشار آب بیرون سرنگ تغییری نمی کند، برای یک پیستون کم اصطکاک، فشار هوای درون سرنگ نیز ثابت می ماند. بنابراین در اینجا انبساط هوای درون سرنگ در فشار ثابت است و در فشار ثابت با افزایش دما حجم زیاد می شود. در عمل، اگر از سرنگی با پیستون کم اصطکاک استفاده کنید و این آزمایش را انجام دهید، ثابت ماندن فشار، افزایش همزمان حجم و دما، و ثابت ماندن نسبت V/T در مدت انجام آزمایش را مشاهده می کنید.
۲ – وقتی هواپیما بالا می رود، فشار هوا کم می شود. گاز یا هوای درون نوشیدنی یا خوراکی که فشار بیشتری از هوای بیرون بسته دارد، باد می کند.

در نوشیدنی این باد کردن، به درِ منعطف ظرف فشار وارد می کند. با فرض هم دما بودن این فرایند، با افزایش حجم ظرف نوشیدنی از فشار هوای داخل آن کاسته می شود. اگر درِ این ظرف بر اثر انبساط هوای محبوس باز نشود، و شما پیش از نوشیدن، ظرف نوشیدنی را تکان دهید، با باز کردن ناگهانی در ظرف، محتویات آن به سمت بیرون پرت خواهد شد.
۳ – مقداری آب را در یک بشقاب بریزید. بعد شمع روشنی را در وسط بشقاب قرار دهید و آنگاه یک ظرف استوانه ای (یا لیوان بلند) را روی شمع داخل بشقاب قرار دهید. مشاهده می کنید آب داخل بشقاب به درون ظرف شیشه ای کشیده می شود و بالا می رود.

شمع شعله ور، هوای داخل استوانه شیشه ای را گرم می کند. فشار این هوا افزایش می یابد و در نتیجه مقداری از هوای داخل استوانه شیشه ای از زیر آن خارج می شود. وقتی شمع خاموش می شود، هوای داخل استوانه از نو سرد و ضمن سرد شدن فشارش کم می شود و بر اثر فشار هوای بیرون استوانه شیشه ای، آب از بشقاب به زیر استوانه و سپس به داخل آن می رود.
ویدیو آزمایش فوق را در زیر مشاهده کنید.
رابطه تغییر چگالی با تغییرات فشار و دما برای گاز کامل
اگر بخواهیم چگالی را وارد معادله حالت کنیم کافیست عملیات زیر را انجام دهیم و به نتایج مهمی دست یابیم.
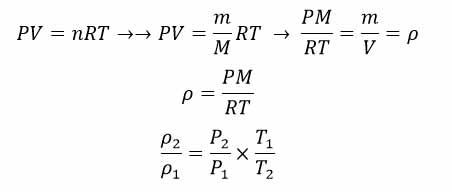
با رابطه بالا می توان تغییر چگالی را در حالت های تعادل ترمودینامیکی محاسبه کرد.
ویدیو آموزشی قانون گازها و معادله حالت
در این ویدیو آموزشی که توسط استاد مصطفی کبیری آماده شده است ،مطالب بالا به همراه حل مثال های مفهومی و محاسباتی، شرح داده می شود.
مشاهده در یوتیوب | مشاهده در آپارات
تمرین هایی از معادله حالت ترمودینامیکی و قانون گاز کامل
تمرین ۱: در شکل زیر، گازی با فشار ۱ اتمسفر و دمای ۲۷ درجه سلسیوس درون استوانه در زیر پیستونی با جرم و اصطکاک ناچیز قرار دارد. چنانچه فشار گاز به ۱٫۲ اتمسفر و دمای آن به ۵۱ درجه سلسیوس برسد، پیستون چند سانتی متر و به کدام طرف جابه جا می شود؟
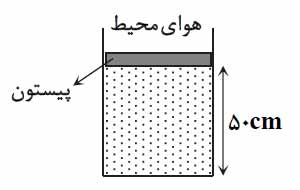
تمرین ۲: چند مول گاز کامل در دمای ۷ درجه سلسیوس درون یک مخزن خالی با گنجایش ۴ لیتر باید وارد کنیم تا فشار گاز درون مخزن به ۷ اتمسفر برسد؟ (R=8, 1atm=105Pa)
تمرین ۳: مقدار معینی گاز کامل با دمای ۹۱ درجه سلسیوس و فشار پیمانه ای ۲۰ کیلوپاسکال درون محفظه ای که دارای حجم متغیر است، وجود دارد. اگر دمای گاز را به ۱۸۲ درجه سلسیوس برسانیم، فشار پیمانه ای آن ۸۰ کیلوپاسکال می شود. طی این تغییرات، چگالی گاز چند برابر می شود؟ (فشار هوای بیرون محفظه ۱۰۰ کیلوپاسکال است)
تمرین ۴: گاز اکسیژن به حجم ۱۰۰۰ سانتی متر مکعب، در دمای ۲۰ درجه سلسیوس و فشار ۱۰۱ کیلوپاسکال آن قدر انبساط می یابد تا حجم آن به ۱۵۰۰ سانتی متر مکعب و فشار آن به ۱۰۶ کیلوپاسکال برسد. الف) تعداد مول های موجود در نمونه و ب) دمای نهایی آن چقدر است؟
تمرین ۵: بهترین خلا آزمایشگاهی، فشاری در حدود p=1.01×۱۰-۱۳Pa دارد. در دمای ۲۹۳ کلوین، چند مولکول گاز در هر سانتی متر مکعب از چنین خلئی وجود دارد؟
تمرین ۶: لاستیک اتومبیل به حجم ۰٫۰۱۶۴ متر مکعب در دمای ۰ درجه سلسیوس از هوایی پر شده است که فشار آن ۲۶۶ کیلوپاسکال است. وقتی هوای داخل لاستیک به دمای ۲۷ درجه سلسیوس و حجم لاستیک به ۰٫۰۱۶۷ متر مکعب برسد، الف) فشار داخل لاستیک چقدر است؟ ب) فشارسنج چه فشاری را نشان می دهد؟
تمرین ۷: اگر ۱ لیتر گاز محبوس در ظرفی، در دمای ۸۰۰ کلوین به حجم ۰٫۵ لیتر فشرده شود، در حالی که فشار آن از ۱ اتمسفر به ۰٫۵ اتمسفر تغییر کند، دمای حاصل بر حسب کلوین چقدر خواهد شد؟
تمرین ۸: مخزنی به حجم ۴۰ لیتر حاوی مخلوطی از گاز های هیدروژن و هلیم در دمای ۱۲۷ درجه سلسیوس و فشار p=2×۱۰۵Pa است. اگر جرم مخلوط ۸ گرم باشد، نسبت جرم هیدروژن به جرم هلیم کدام است؟
تمرین ۹: یک حباب هوا به حجم ۱٫۴ سانتی متر مکعب از عمق دریاچه ای که فشار در آن محل ۱۸۰ کیلوپاسکال و دما ۷ درجه سلسیوس است، به سطح دریاچه می رسد که دما ۲۷ درجه سلسیوس و فشار ۱۰۰ کیلوپاسکال است. در این انتقال حجم حباب چند سانتی متر مکعب تغییر می کند؟
تمرین ۱۰: در محفظه ای به حجم ۳۳٫۶ لیتر مخلوطی از دو گاز اکسیژن و هلیم وجود دارد. فشار گاز ۲۰۰ کیلوپاسکال و دمای آن ۷ درجه سلسیوس است. اگر جرم گاز ۵۴ گرم باشد، چند درصد مولکول های آن اکسیژن است؟ (جرم مولکولی هیدروژن ۴ گرم بر مول و اکسیژن ۳۲ گرم بر مول و ثابت عمومی گاز ها را ۸ در نظر بگیرید.)
دانلود جزوه و حل تمرین های معادله حالت ترمودینامیکی و قانون گاز ها
کاربرد قانون گازها در مسئله های فشار در شاره
برای مشاهده ویدیو کاربرد قانون گازها در حل مساله های فشار در شاره ها بویژه در لوله های U شکل و ظرف هایی که در آن مایع و گاز به تعادل می رسند می توانید از لینک های زیر استفاده کنید.
مشاهده در یوتیوب | مشاهده در آپارات



3 دیدگاه دربارهٔ «معادله حالت ترمودینامیکی و قانون گاز ها»
سلام وخداقوت. خوب بود.اگرخلاصه ترمودیناک دارید، بگذارید.تشکر
سلام کارتون عالیه، عذر میخوام از چه نرم افزاری استفاده میکنید برای نوشتن؟ خیلی روون و راحت مینویسی. ممنون میشم بگید
سلام و سپاس. onenote